2018年3月6日,美国FDA批准中裕新药(TaiMed)的Trogarzo(ibalizumab-uiyk,TMB-355)上市,Trogarzo是由中裕新药创制、药明生物协助生产的新型抗逆转录病毒药物。
Trogarzo获批上市,缔造多个第一(由新闻整理,如有不当遗漏还请谅解补充):
第一个,HIV领域中获批的单株抗体蛋白质新药
第一个,HIV长效型新药
第一个,台湾厂商自主完成三期并送件申请,且获得美国FDA新药批准
第一个,台湾由美国FDA批准的蛋白质新药
第一个,美国FDA在2018年批准的创新生物药
第一个,10多年来具有全新作用机制的抗逆转录病毒疗法
Trgoarzo获得美国FDA生物制剂药品上市查验登记核准,药价(whole sales price)定为每人每年11.8万美元。这款新药与其它抗逆转录病毒药物联合使用,由医疗专业人员每14天静脉注射一次,能让那些无药可用的HIV感染者受益,有望能改善预后。
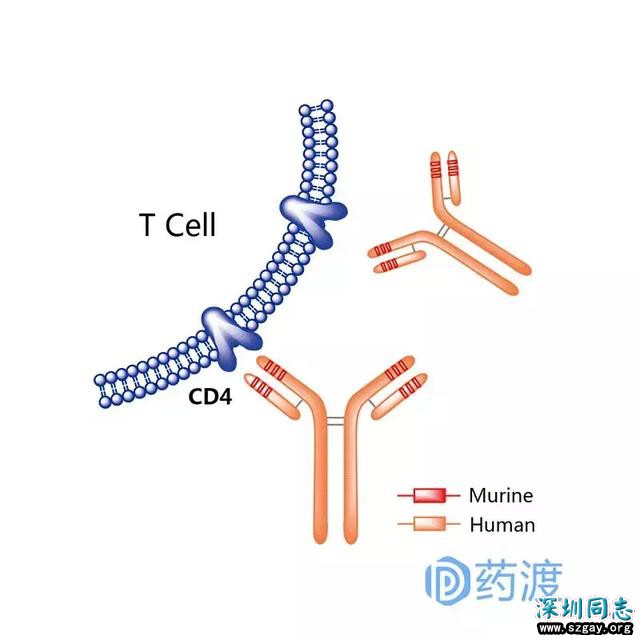
Ibalizumab
Ibalizumab是一种靶向于CD4的人源化IgG4型单克隆抗体,用于治疗HIV-1病毒感染,能够结合T细胞表面的HIV病毒主要受体CD4,以阻止这些细胞遭到病毒的入侵。2016年在美国提交BLA上市申请。Ibalizumab最初由Tanox(被基因泰克收购)开发,之后TaiMed Biologics获得了该药物的全球研发和商业化授权。2014年,ibalizumab在美国被认证为治疗HIV-1感染的孤儿药。2015年,美国FDA将ibalizumab治疗HIV-1感染申请列入快速审批名单。

|