 别怕,我们有治疗办法。
别怕,我们有治疗办法。
来源|医学界消化肝病频道
HCV/HIV共感染的现状
丙肝患者合并人类免疫缺陷病毒(HIV)感染很常见[1-4],且合并HIV感染的患者基线感染丙型肝炎病毒(HCV)时,HCV病毒载量更高,HCV相关肝病的进展也很快,肝硬化、晚期肝病及肝细胞癌的风险大大增加[5-6],这已成为 HIV-1型患者发病和死亡的主要原因[7-10]。同时,合并HCV感染可促进HIV患者进展为获得性免疫缺陷综合征(AIDS)的速度大大加快,且使AIDS相关死亡率增加。
 既往传统的聚乙二醇干扰素和利巴韦林治疗HCV/HIV共感染患者持续病毒应答率(SVR)远低于HCV单一感染患者,且疗程长,不良事件发生率高,患者耐受率低。所以,虽然DAA(直接抗病毒药物)的问世改变了HCV的治疗[11-15],缩短了疗程,提高了HCV治疗的整体应答率,但是由于一些DAA药物在治疗HCV/HIV共感染患者时需联合聚乙二醇干扰素或利巴韦林,导致HCV/HIV共感染患者目前的治疗方案不良反应仍较多,且疗效欠佳,寻找令人满意的HCV/HIV共感染患者更优治疗方案迫在眉睫。
既往传统的聚乙二醇干扰素和利巴韦林治疗HCV/HIV共感染患者持续病毒应答率(SVR)远低于HCV单一感染患者,且疗程长,不良事件发生率高,患者耐受率低。所以,虽然DAA(直接抗病毒药物)的问世改变了HCV的治疗[11-15],缩短了疗程,提高了HCV治疗的整体应答率,但是由于一些DAA药物在治疗HCV/HIV共感染患者时需联合聚乙二醇干扰素或利巴韦林,导致HCV/HIV共感染患者目前的治疗方案不良反应仍较多,且疗效欠佳,寻找令人满意的HCV/HIV共感染患者更优治疗方案迫在眉睫。
HCV/HIV共感染治疗觅得曙光
Mark Sulkowski等[13]人开展的随机、平行、多中心、开放、国际临床2期试验(C-WORTHY)及Jürgen K Rockstroh等16人在欧美等九个国家的37个国际医学中心开展的非随机对照、多中心、开放、单组3期临床试验(C-EDGE CO-INFECTION)均证实了Zepatier(由GZR-NS3/4A蛋白酶抑制剂和EBR- NS5A抑制剂组成的固定剂量组合片剂)治疗HCV/HIV共感染患者安全有效。其研究结果分别于2015年3月及8月发表在了医学顶级期刊《Lancet》(IF:47.831)和《Lancet HIV》(IF: 9.842)杂志。
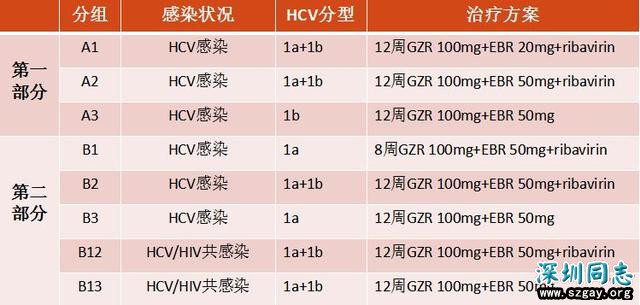
C-WORTHY研究[13]纳入研究对象218例。纳入标准为18岁以上的初治患者,1型HCV单纯感染或合并HIV感染,体重≥50 kg,外周血HCV RNA≥10 000 IU/ mL,且不合并肝硬化、肝细胞癌或失代偿性肝病。实验分为两个部分(见下表),各组治疗结束后均随访12周。
表:C-WORTHY研究分组情况
 C-EDGE CO-INFECTION研究[16]共纳入218例研究对象。纳入标准为18岁以上的患者,HCV基因型1、4或6感染且合并HIV-1感染,基线HCV RNA≥10 000 IU/mL,从未接受过抗逆转录病毒治疗(ART),或入组前ART治疗至少稳定8周。所有患者接受Zepatier治疗12周,并于治疗结束后随访12周。
C-EDGE CO-INFECTION研究[16]共纳入218例研究对象。纳入标准为18岁以上的患者,HCV基因型1、4或6感染且合并HIV-1感染,基线HCV RNA≥10 000 IU/mL,从未接受过抗逆转录病毒治疗(ART),或入组前ART治疗至少稳定8周。所有患者接受Zepatier治疗12周,并于治疗结束后随访12周。
D-C-WORTHY研究和C-EDGE CO-INFECTION研究均采用治疗结束12周时持续病毒学应答(SVR12)为主要终点。
结果显示
1
Zepatier治疗HCV/HIV共感染患者效果显著
C-WORTHY研究[13]结果表明Zepatier治疗1型HCV合并HIV感染患者可获得SVR12率最高达98%,且基因型1分型(1a、1b)及是否加用利巴韦林均不影响Zepatier的高效。
C-EDGE CO-INFECTION研究[16]结果表明Zepatier治疗HCV/HIV共感染患者所获得的SVR12高达96%,且复发率低。此外,合并肝硬化、基线IL28B非CC基因型、基线HCV病毒载量超过800,000 IU/mL、基线有NS3耐药相关变异体等复杂因素均不影响Zepatier的疗效。同时,肝酶浓度增加及短暂的HIV病毒血症等不良事件也不影响Zepatier治疗疗效。
2
Zepatier治疗不干扰HIV治疗疗效
C-WORTHY研究[13]结果表明Zepatier治疗HCV/HIV共感染患者血红蛋白浓度没有下降,整个治疗过程CD4 T细胞计数总体增加。C-EDGE CO-INFECTION研究[16]表明整个试验过程患者CD3或CD4 T细胞计数及治疗12周或随访12周时的百分比没有显著的变化,说明Zepatier不会影响患者的HIV治疗疗效。
3
Zepatier治疗HCV/HIV共感染患者安全性高
C-EDGE CO-INFECTION研究[16]表明应用Zepatier治疗,HCV/HIV共感染患者普遍可以耐受,不良反应少。最常见的不良反应大多是轻微的疲劳、头痛及恶心,严重不良事件发生率很低,而且与治疗药物无关。两个试验研究中没有1例患者因为不良事件的发生而中断研究。
总结
同时感染HCV/HIV是临床非常棘手的一大难题,不仅让患者的病死率大大增加,还由于目前的治疗方式需要联合聚乙二醇干扰素或利巴韦林应用,而存在较多的副作用。
此文两篇研究都证实Zepatier治疗HCV/HIV共感染患者可获得高SVR12,安全可靠,而且不影响HIV治疗药物的效果,可谓为HCV/HIV共感染患者带来了希望的曙光。
 小贴士
小贴士
默沙东公司研发的Zepatier是由grazoprevir(GZR,100 mg,NS3/4A蛋白酶抑制剂)和elbasvir(EBR,50 mg,NS5A抑制剂)组成的固定剂量组合片剂,每日一次服用,疗程共12周,已被FDA批准用于治疗基因型1、4型丙肝。
参考文献:
[1] Soriano V, Mocroft A, Rockstroh J, et al. Spontaneous viral clearance, viral load, and genotype distribution of hepatitis C virus(HCV) in HIV-infected patients with anti-HCV antibodies in Europe. J Infect Dis 2008; 198: 1337–44.
[2] Koziel MJ, Peters MG. Viral hepatitis in HIV infection. N Engl J Med 2007; 356: 1445–54.
[3] Peters L, Mocroft A, Lundgren J, et al. HIV and hepatitis C co-infection in Europe, Israel and Argentina: a EuroSIDA perspective. BMC Infect Dis 2014; 14 (suppl 6): S13.
[4] Lacombe K, Rockstroh J. HIV and viral hepatitis coinfections:advances and challenges. Gut 2012; 61 (suppl 1): i47–58.
[5] Lo Re V III, Kallan MJ, Tate JP, et al. Hepatic decompensation in antiretroviral-treated patients co-infected with HIV and hepatitis C virus compared with hepatitis C virus-monoinfected patients:a cohort study. Ann Intern Med 2014; 160: 369–79.
[6] Rockstroh JK, Peters L, Grint D, et al. Does hepatitis C viremia or genotype predict the risk of mortality in individuals co-infected with HIV? J Hepatol 2013; 59: 213–20.
[7] Monga HK, Rodriguez-Barradas MC, Breaux K, et al. Hepatitis C virus infection-related morbidity and mortality among patients with human immunodefi ciency virus infection. Clin Infect Dis 2001;33: 240–47.
[8] Konerman MA, Mehta SH, Sutcliff e CG, et al. Fibrosis progression in human immunodefi ciency virus/hepatitis C virus coinfected adults: prospective analysis of 435 liver biopsy pairs. Hepatology 2014; 59: 767–75.
[9] Pinchoff J, Drobnik A, Bornschlegel K, et al. Deaths among people with hepatitis C in New York City, 2000–2011. Clin Infect Dis 2014; 58: 1047–54.
[10] Taylor LE, Swan T, Mayer KH. HIV coinfection with hepatitis C virus: evolving epidemiology and treatment paradigms.Clin Infect Dis 2012; 55 (suppl 1): S33–42.
[11] Osinusi A, Townsend K, Kohli A, et al. Virologic response following combined ledipasvir and sofosbuvir administration in patients with HCV genotype 1 and HIV co-infection. JAMA 2015; 313: 1232–39.
[12] Eron JJ, Lalezari J, Slim J, et al. Safety and efficacy of ombitasvir-450/r and dasabuvir and ribavirin in HCV/HIV-1 co-infected patients receiving atazanavir or raltegravir ART regimens.J Int AIDS Soc 2014; 17 (suppl 3): 19500.
[13] Sulkowski M, Hezode C, Gerstoft J, et al. Efficacy and safety of 8 weeks versus 12 weeks of treatment with grazoprevir (MK-5172) and elbasvir (MK-8742) with or without ribavirin in patients with hepatitis C virus genotype 1 mono-infection and HIV/hepatitis C virus co-infection (C-WORTHY): a randomised, open-label phase 2 trial. Lancet 2015; 385: 1087–97.
[14] Sulkowski MS, Eron JJ, Wyles D, et al. Ombitasvir, paritaprevir co-dosed with ritonavir, dasabuvir, and ribavirin for hepatitis C in patients co-infected with HIV-1: a randomized trial. JAMA 2015;313: 1223–31.
[15] Molina JM, Orkin C, Iser DM, et al. Sofosbuvir plus ribavirin for treatment of hepatitis C virus in patients co-infected with HIV(PHOTON-2): a multicentre, open-label, non-randomised, phase 3 study. Lancet 2015; 385: 1098–106.
[16] Jürgen K Rockstroh, Mark Nelson, Christine Katlama,et al.Efficacy and safety of grazoprevir (MK-5172) and elbasvir(MK-8742) in patients with hepatitis C virus and HIV co-infection (C-EDGE CO-INFECTION): a non-randomised,open-label trial.Lancet HIV. 2015 Aug;2(8):e319-27. |