撰文丨望夜
责编丨迦溆
人类免疫缺陷病毒(HIV)多年来始终是病毒学的研究热点之一,HIV相关的结构文章更是生物学顶级期刊的 “常客”。针对HIV的药物开发,也成为各大制药公司争相追捧的“明星”。近日,Nature杂志在线发表了美国康奈尔大学Volker M. Vogt教授组与弗吉尼亚大学Owen Pornillos教授组合作完成的一项工作【1】,通过结构和功能学研究,确认磷酸肌醇是HIV-1病毒组装的辅助因子。
磷酸肌醇(Isositol phosphates,IP)是一类单磷酸或多磷酸化的肌醇,具备多种细胞功能,在细胞生长,凋亡、迁移、内吞和分化中发挥关键作用。常见的IP分子有IP、IP2、IP3、IP4、IP5、IP6。IP6(inositolhexakisphosphate,肌醇六磷酸,也称植酸),发现于1903年,是植物组织主要的磷贮存形式,在麸皮和种子中含量较高。IP6分解可产生IP5、IP4、IP3等不同形式。在哺乳动物中,IP6分布广泛,是含量最丰富的一类磷酸肌醇,依细胞类型和发育阶段不同,其浓度在10-40 μM不等【2】。人体中的IP6通常无法从食物获取,须由肌醇和磷酸分子合成。IP6的一项重要生物学功能是参与DNA修复,在非同源末端连接过程中作为辅助因子【3】。此外,还有报道称其参与mRNA由细胞核向胞质的转运【4】,在抗癌(预防和治疗)中也能起作用。
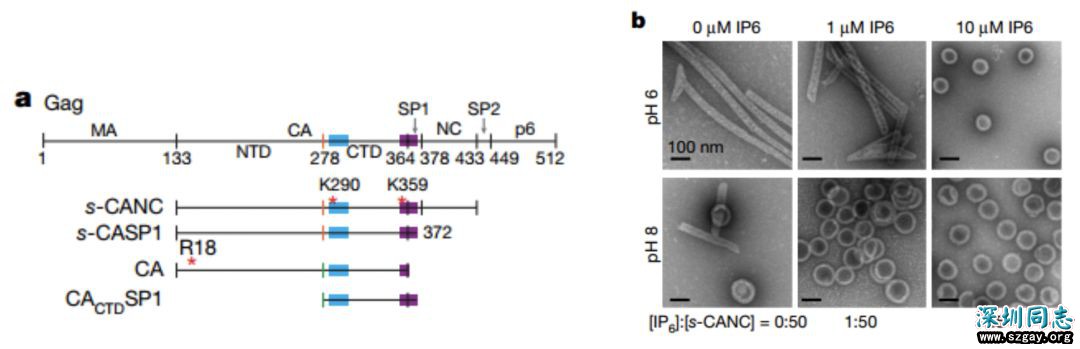
具体到HIV-1,早先研究表明Gag蛋白的组装过程分成两个阶段:初期,由Gag上一段14个氨基酸的间隔多肽1(spacerpeptide 1,SP1)及其后紧邻的七肽区折叠成六螺旋束(six-helix bundle)样结构,促使Gag蛋白聚集成六聚体并进一步装配成非成熟状态的六角形栅格(hexagonal lattice)结构;而当Gag被酶切启动成熟过程后,非成熟栅格解聚,释放出衣壳结构域(capsid,CA)重装配成成熟状态的圆锥样衣壳。
六螺旋束的折叠和酶切正是整个组装和成熟过程的限速步骤【5】,而六螺旋束也已成为HIV-1抑制剂的重要靶点【6】。2016年,Owen Pornillos组在eLife杂志上报道了非成熟状态Gag蛋白CA-SP1复合物的晶体结构【7】;同一天,德国莱布尼茨研究所John A. G. Briggs教授组在Science杂志上发表了使用断层成像(Tomography)重构的非成熟状态Gag组装结构【8】。两个月前,北京大学生物医学工程系的陈匡时教授组在PNAS上发表了题为Roles of Gag-RNA interactions in HIV-1 virusassemblydecipheredby single-molecule localization microscopy的研究论文,利用光敏荧光显微技术研究了HIV-1组装的动态过程,发现Gag组装的全程都是病毒vRNA依赖的【9】。
IP6促进HIV-1的组装也非新鲜事,已有研究称其与Gag蛋白的MA和NC结构域存在相互作用【10】,本文就是为了回答IP6如何影响Gag组装。研究者首先构建了包含有CA到NC结构域的一段Gag蛋白(s-CANC)(图1)。为防止发生自成熟,还将N端多向前额外截取了一个丝氨酸,以干扰成熟组装所需β-发卡结构的形成。依照前人研究,该构建通常只能在偏酸性(pH 6)条件下形成成熟的病毒样颗粒(VLP),但他们通过负染电镜照片观察发现,在偏酸性(pH 6)和偏碱性(pH 8)条件下都出现了成熟的VLP(图1)。但当IP6存在时,可以显著地诱导球形非成熟状态VLP的形成,且在偏碱性时效果更显著。于是作者推测,IP6具有强制组装非成熟VLP的能力。
<div class="J-article downloadBtn downloadBtn-pic"><div align=center class="pic-wrap">
|